
Sorry ,This page is written in JAPANESE. English version is not available
内臓リーシュマニア症の症状と診断
内臓リーシュマニア症(またはKALA-AZAR) ICM 085.0.
小児の内臓リーシュマニア症
小児の内臓リーシュマニア症は地中海沿岸に多いが、よそのリーシュマニアの流行地では殆ど見かけない。一番の好発年令は2-3歳である。潜伏期は1-2ヵ月かときにそれより長くなる。ある種の症例ではサシチョウバエの吸血時点から水ほう性丘疹性下かんが出現するが、いつも目立たず、一過性で、簡単に見逃される。
発病期:密かに進行し、子供は少しずつ動きが弱まり、倦怠が増し、悪化していく。蒼白、痩せ、ときに下痢が見られる。間歇性の発熱が重症度に応じて続き、繰り返す。診断は浸淫地帯でも肝脾腫を欠くことがあり、困難である。
全身期:数週間前後で全身性症候群と脾肝リンパ節症候群を合併する病態像が完成する。
全身性症候群:熱発が持続し、《気が狂った》ような錯乱、脱臼や、一日中足を引きずる動作があり、いかなる対症療法にも抵抗する。蒼白は極端で、《老いた蝋人形》と称される。これは貧血といろいろな症状から導かれる合併症に因る。四肢と胸部は萎縮し、対照的に腹部は膨大する。
脾肝リンパ節症候群:脾は触知され、しばしば臍下まで巨大化する。脾は固く、平滑で、可動性があり、硬結を認め、典型的なものは前縁に深い切痕が明らかである。肝腫大はより明白で、固く、硬結があり、腹水や黄疸はない。時折副血行路を見るとの記載がある。リンパ節腫大は晩期に現われるが、初期に見られることもある。表在性リンパ節症は固く、可動性があり、硬結がある。深在性リンパ節症は縦隔に顕著で、理学所見で見つからなくても放射線学的に発見される。
その他の所見:急性下痢症、出血性症候群(血小板減少性紫斑)、皮膚所見(大人には極めて希)も記載されることがある。
経過:本症は致死性で治療法がない。小児は悪液質に陥り、細菌感染、出血性症候群、赤痢様症状で死亡する。自然寛解も起こり得る。
大人の内臓リーシュマニア症
大人の内臓リーシュマニア症はインドに通常見られる型だが(図1)、中国、黒アフリカの一部の国々、南米にもある。1980年代の初頭から欧州の地中海沿岸部で大人と子供の症例が見つかっている。免疫不全の者(移植、AIDS)は覆面型、重症型を示すことがある。
図1
発病期:発病は小児例より激烈で、ひどい熱発がときにマラリアと間違えられる。
全身期:発熱は無秩序に上昇する。脾肝リンパ節症候群は小児ほど多くない。逆に皮膚所見が頻繁である。
経過:通常は数ヵ月から数年で、悪液質、出血性症候群、細菌や結核感染で死亡する。自然寛解は稀である。ごく一部のkala-azar患者には多発性非潰瘍性丘疹が生ずる。この場合内臓リーシュマニア症の治療が成功した後、Post Kala-Azar Dermal Leishmanoid (PKDL)と称される皮膚病変を起こすことがある(図2)。
図2
内臓リーシュマニア症の診断
臨床診断
臨床診断は困難で、浸淫地帯でも同様である。内臓リーシュマニア症はひ腫を伴う発熱性疾患の全てに類似するからである。マラリア、サルモネラ症、ある種のウイルス性疾患、肝ひ腫のある結核、悪性血液疾患やリンパ腫が挙げられる。
生物学的診断
疑診所見:血算では正球性正色素性貧血があり、網赤血球が増加していない。白血球減少が一定して見られ、時に白血球値が2,000/ul前後に低下していることが重要である。血沈は1時間値が100mm前後になる。蛋白の電気泳動ではアルブミンが減少し、ポリクローナル性(時にモノクローナル性)のγグロブリンの増加が認められる(図3・治療前Aと治療後Bの電気泳動パターンの変化)。免疫電気泳動では変性した抗DNAIgG抗体、リウマトイド因子、クリオグロブリン、循環型免疫複合体が増加し、ポリクローナル性γグロブリン血症が証明される。アルブミン減少症とγグロブリン増加症のそれぞれの程度によって、小児では総蛋白量の低下、大人では上昇を示すことがある。この現象を利用して、浸淫地のフィールドではアルデヒド試験がスクリーニングに多用される(図4・IgG値が上昇している左側の陽性血清は凝固している)。プロトロンビン時間は延長している。特異的免疫法はL.donovaniに対する間接的免疫蛍光法が広く用いられ、疫学調査にも利用されている。これは大変幼弱な子供や免疫低下状態の者には偽陰性となることがある。この他、ELISA、ウェスタンブロット法、直接的赤血球凝集法はあまり用いられない。
確定診断:リーシュマニアを組織単球内に証明することによる。骨髄液をMay-Grunwald-Giemsa染色で骨髄塗沫標本を調べる(図5)。塗沫標本では原虫数少ないことが多く、沢山の試料を検鏡する。肝生検によるKupffer細胞の検査や小腸粘膜の生検も有用である。ひ臓の内容液を吸引(図6)すれば、原虫は大抵検出出来るが、破裂の危険もあることに注意する。検鏡で陰性でも、NNN(Novy-Nicolle-McNeal)二相培地か一相培地(RPMI培地に子牛胎児血清を添加したもの、Parker-FVS培地)で原虫を培養すれば、診断はさらに確実となる。ハムスターに接種し、病変を作ることも出来る(図7)。
図3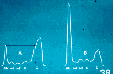 図4
図4 図5
図5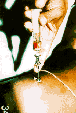
図1 図1
図1
 熱帯医学データベースに戻る
熱帯医学データベースに戻る
 AMDAホームページに戻る
AMDAホームページに戻る
このページは、アムダ企画のご協力により作成されました。








 熱帯医学データベースに戻る
熱帯医学データベースに戻る

